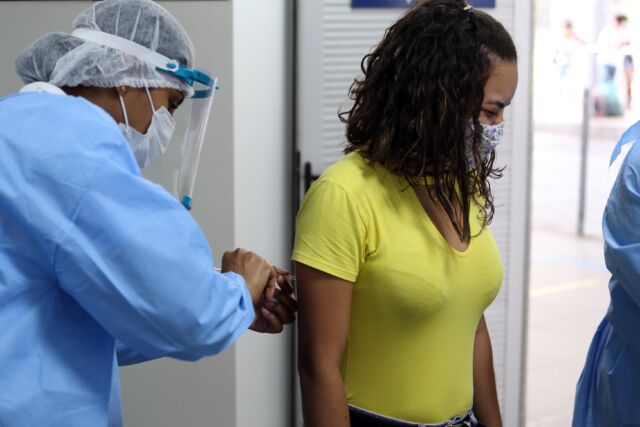
A Agência Nacional de Vigilância Sanitária (Anvisa) divulgou nesta quarta-feira (2), um guia com as exigências definidas para o pedido do uso emergencial das vacinas da Covid-19.
- Segundo a reguladora, cada caso pedido será analisado. A decisão vai ser tomada pela Diretoria Colegiada;
- Serão considerados estudos não-clínicos e clínicos;
- Vai ser avaliada a qualidade, boas práticas de fabricação, estratégias de monitoramento e controle, resultados provisórios de ensaios clínicos, entre outras evidências científicas;
- A empresa interessada deverá apresentar as informações que comprovem que a fabricação do produto garantem a qualidade da vacina;
Anvisa ressalta que o uso emergencial de um produto, só será liberado apenas para o público previamente definido e testados nos estudos. Além disso, a autorização não irá substituir o registro sanitário no Brasil, que deve ser exigido para a ampliação do produto a toda população.
Esta modalidade de uso emergencial é temporário, está prevista em regularmente e pode trazer benefícios a determinados e controlados grupos, como medida adicional para enfrentamento da pandemia.